StemSpan™ 造血细胞培养基及添加物
可重复的造血干细胞与祖细胞扩增及分化
在StemSpan™无血清 造血细胞扩增培养基中添加造血生长因子和/或其他刺激物后,可促进正常或白血病人造血干细胞与祖细胞(HSPCs)的扩增,或谱系特异性分化。StemSpan™ StemSpan™ 扩增添加物是将重组人细胞因子与其他添加物经过预混合的混合物,当加入 StemSpan™ 培养基时,可选择性地扩增 CD34+ 干细胞与祖细胞,或刺激其分化为红系、髓系(粒细胞或单核细胞)或巨核细胞祖细胞。完整试剂盒包含培养基、添加物和基质,可在无基质条件下实现CD34+细胞向T细胞或NK细胞的扩增及谱系特异性分化。此外,包含培养基、添加物和小分子化合物的试剂盒,可培养与扩增从慢性髓系白血病(CML)或急性髓系白血病(AML)患者样本中分离的CD34+细胞。
为何选择StemSpan™培养基与扩增添加物?
- 精心筛选的各组分可最大限度减少批次间差异,持续提供最佳的培养条件。
- 培养基不含细胞因子,可灵活添加 StemSpan™ 扩增添加物、细胞因子和/或其他添加剂。
- 与其他测试培养基相比,StemSpan™SFEM II 配合相应扩增添加物,能更高效地支持 CD34+细胞扩增及红系细胞、粒细胞、单核细胞和巨核细胞的分化。
- 除无血清且无异种成分的配方外,StemSpan™-AOF 是首个商业化的无动物成分的 HSPCs 培养基。
cGMP级造血干细胞扩增培养基
在开展造血细胞与基因治疗研究时,通常需要考虑下一步是否会进行临床转化。cGMP 级别的 StemSpan-AOF,不含动物源成分,助您更顺畅地通过监管审核。StemSpan™-AOF仅包含重组蛋白和合成组分,并按照相关cGMP标准在经过认证的质量管理体系下进行生产制造和测试,实现从实验室到临床的全方位应用。获取更多关于合规性的信息,请访问STEMCELL >
- 培养7天后可实现人脐带血来源CD34++细胞的20倍扩增
- 维持培养体系中原始的CD34brightCD90+CD45RA-细胞群比例
- 适用于基因组编辑实验方案
- 无动物成分及酚红
- 按照相关cGMP标准生产与测试
- 原材料全程可追溯
优势:
不确定哪款 StemSpan™ 配方适合您的研究?
根据需求选择最合适的 StemSpan™ 培养基——无论是CD34+细胞扩增,还是分化为红系细胞、粒细胞、单核细胞及巨核细胞。
实验数据
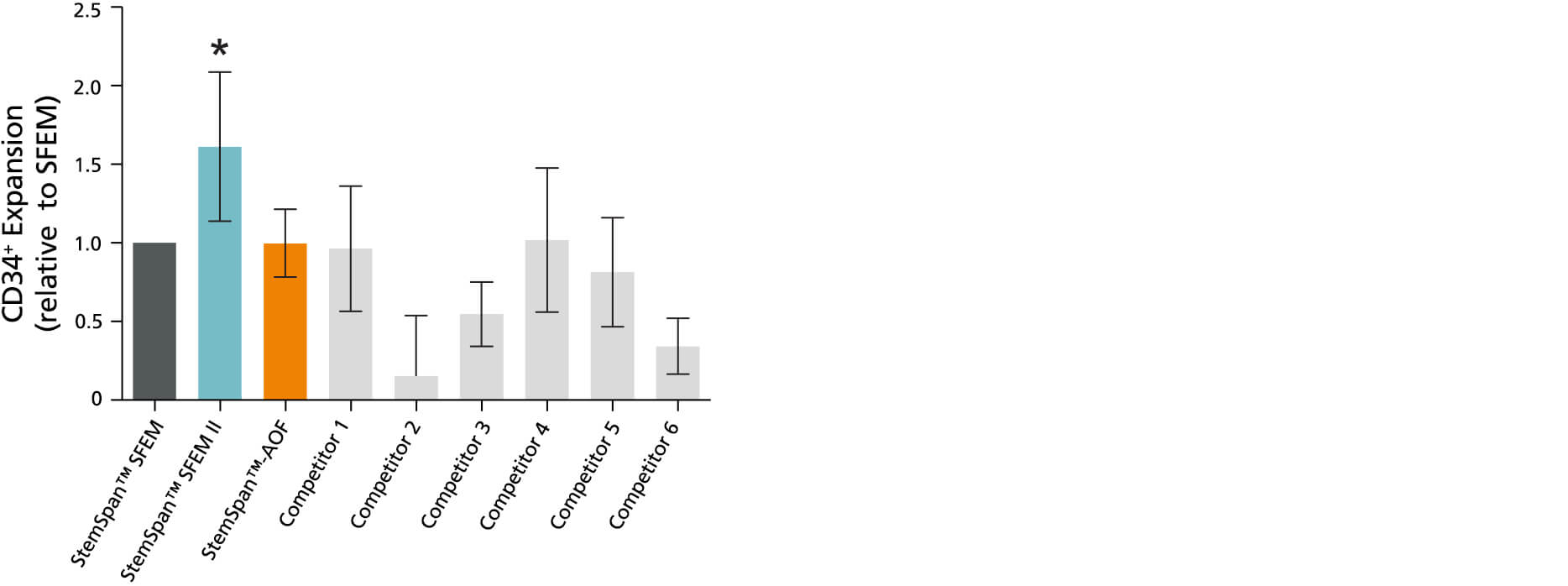
图1. 相比于测试的其他商业培养基,含CC100细胞因子混合物的StemSpan™ SFEM II无血清扩增培养基可更好地支持人CD34+细胞的扩增
将纯化的CB来源的CD34+细胞在StemSpan™ SFEM、SFEM II和AOF培养基以及其他公司的6种商业培养基(浅灰色柱;随机顺序,6种商业培养基包括StemLine II(Sigma)、HPGM(Lonza)、HP01(Macopharma)、SCGM(Cellgenix)、StemPro34(Life Technologies)和X-Vivo-15(Lonza))中培养7天。所有培养基均添加有StemSpan™ CC100细胞因子混合物(产品号 #02697)。竖线表示95%的置信区间。结果显示,除StemSpan™-AOF培养基,在 StemSpan™ SFEM II中产生的细胞数量细胞明显高于其他培养基中产生的细胞数量。(*P<0.05,配对t检验,n=6)。
注:所示的StemSpan™–AOF数据是使用原始的含酚红版本的StemSpan™– ACF(产品号 #09855)生成的。然而,内部测试表明,新的不含酚红、cGMP生产的StemSpan™–AOF(产品号 #100-0130)性能相当。
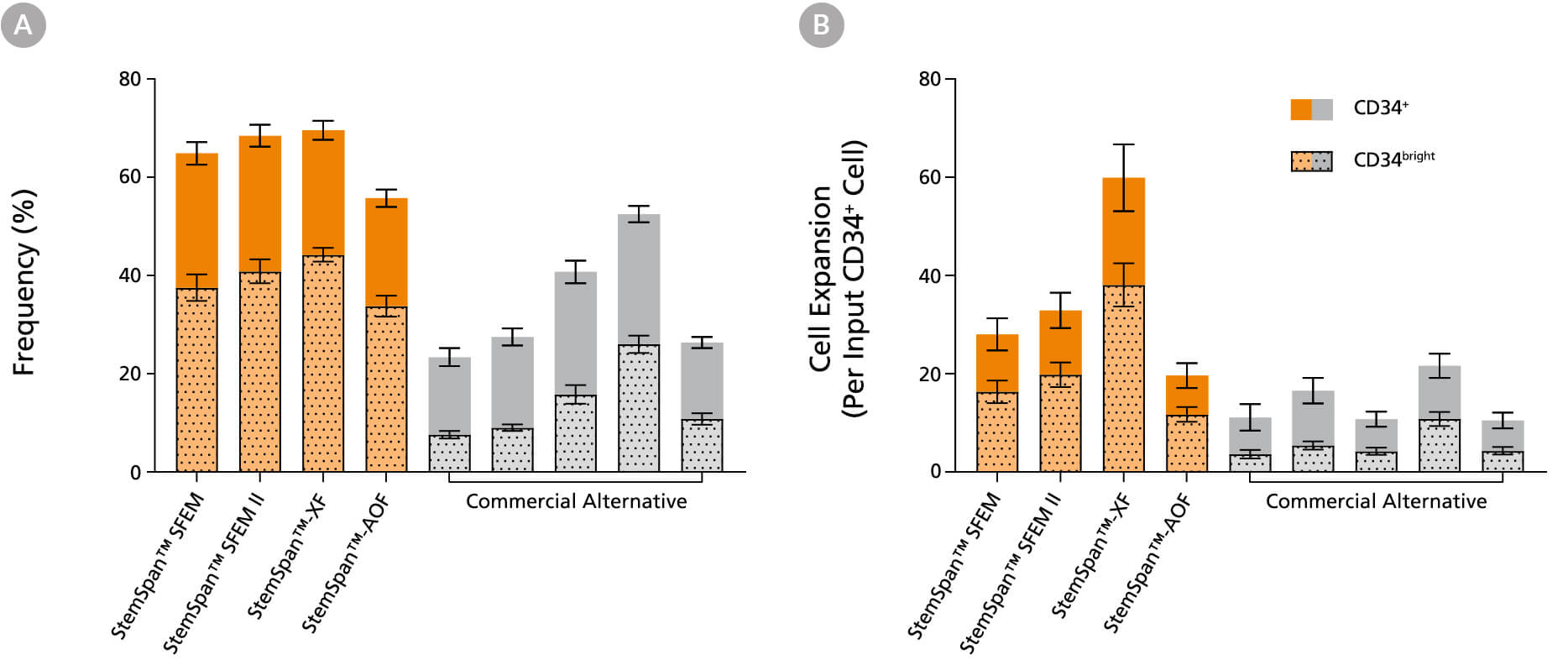
图2. 相比于测试的其他商业培养基,StemSpan™ 培养基可更好地支持人CD34+细胞和CD34bright细胞的扩增
将纯化的CB来源+细胞在 StemSpan™ 培养基(SFEM、SFEM II、AOF和XF,橙色柱)和其他五家供应商的培养基(商业化培养基,灰色柱)中培养7天。所有培养基均添加了 StemSpan™ CD34+扩增添加物 和UM171*如图1 所示,通过流式细胞术分析培养物中CD34+和CD34bright活细胞的(A)比例及(B)细胞扩增情况。与其他测试的商业化培养基相比,在 StemSpan™ 培养基中培养的 CD34+ 和 CD34bright 细胞的扩增显著较高( StemSpan™SFEM、SFEM II 和 XF 与其他五家商业化培养基相比时,P<0.05,采用单因素方差分析和Dunnett事后检验计算)。CD34bright细胞群富含功能性干/祖细胞(见图4)数据以平均值 ± SEM表示(n=8)。
*当使用终浓度为1μM的UM729(产品号 #72332)时,预计会得到类似的结果。 有关更多信息,包括比较UM171和UM729的数据,请参阅Fares et al., 2014。
注:所示的 StemSpan™–AOF 数据是使用原始的含酚红版本的 StemSpan™–ACF(产品号 #09855)生成的。然而,内部测试表明,新的不含酚红、cGMP生产的StemSpan™–AOF(产品号 #100-0130)性能相当。

图3. 通过流式细胞术分析在StemSpan™ SFEM II培养基中培养7天的动员的外周血CD34⁺细胞
将纯化的G-CSF动员外周血(mPB)来源的 CD34+ 细胞,在添加了StemSpan™ CD34+扩增添加物(产品号 #02691)和UM729(产品号 #72332)的StemSpan™SFEM II培养基(产品号 100-0130)中培养7天。 7天后,细胞经CD34、CD45RA、CD90、EPCR和CD133荧光标记抗体以及活力染料 Zombie Yellow™ 染色,并用流式细胞仪进行分析。CD34与FSC散点图(左)中的水平虚线表示CD34标志物表达的荧光减一(FMO)对照。通过连续设门(橙色)确定图2、3、4中显示的活CD34bright活细胞、CD34bright CD90⁺CD45RA⁻ 活细胞及 CD34brightCD45RA⁻CD90⁺CD133⁺EPCR⁺ 活细胞的百分比。

图4. 相比于测试的其他商业培养基,StemSpan™ 培养基支持动员外周血来源的HSPCs达到同等或更高的扩增水平
将G-CSF动员外周血(mPB)来源的纯化CD34+细胞以10000细胞/mL的浓度分别接种于StemSpan™培养基(SFEM、SFEM II、AOF和XF,橙色柱)和其他六种商业化培养基(灰色柱)。所有培养基均添加StemSpan™ CD34+ 扩增添加物和UM729(1uM)。培养7天后,如图1所示,通过流式细胞术分析CD34bright、CD34brightCD45RA⁻CD90⁺ 及 CD34brightCD45RA⁻CD90⁺CD133⁺EPCR⁺活细胞的(A)比例与(B)扩增倍数。扩增倍数已根据 StemSpan™ SFEM 为基准进行标准化(柱上方数字表示接种 CD34+ 细胞的平均产量 ± SEM)。与测试的其他商业化培养基相比,StemSpan™ 培养基支持 CD34bright 细胞、CD34brightCD45RA⁻CD90⁺ 细胞及 CD34brightCD45RA⁻CD90⁺CD133⁺EPCR⁺ 细胞(后续各亚群的功能性干/祖细胞含量逐步增加)相当或更高的扩增水平。数据以平均值 ± SEM 显示,n =5。

图5. 通过有限稀释移植试验评估在StemSpan™-AOF或StemSpan™ SFEM II中扩增的脐带血CD34⁺细胞长期SCID重建细胞能力
扩增7天后,将10、100、250及2500个初始CD34⁺细胞的子代细胞静脉注射至亚致死剂量照射的NSG小鼠体内。对于未培养CD34⁺细胞,分别移植250、500和2500个细胞。移植后约20周检测小鼠骨髓中表达泛白细胞标志CD45的人源细胞比例。并以 >0.1% CD45⁺ 细胞作为判定小鼠是否成功移植的阈值。使用 Walter and Eliza Hall医学研究所的 ELDA软件进行极限稀释分析。长期造血干细胞(LT-HSC)比例(红线)及95%置信区间(方框)以“1/初始CD34⁺细胞数(相当于第0天)”表示;n=2次独立实验,每次实验每组2-7只小鼠。显著性水平*P<0.001(卡方检验)。与新鲜CD34⁺细胞相比,StemSpan™ SFEM II和StemSpan™-AOF扩增的细胞分别使LT-HSC增加约36倍和17倍,其SCID重建细胞(SRC)比例分别为1/23、1/48和1/835(对应StemSpan™ SFEM II、StemSpan™-AOF及新鲜对照组)。
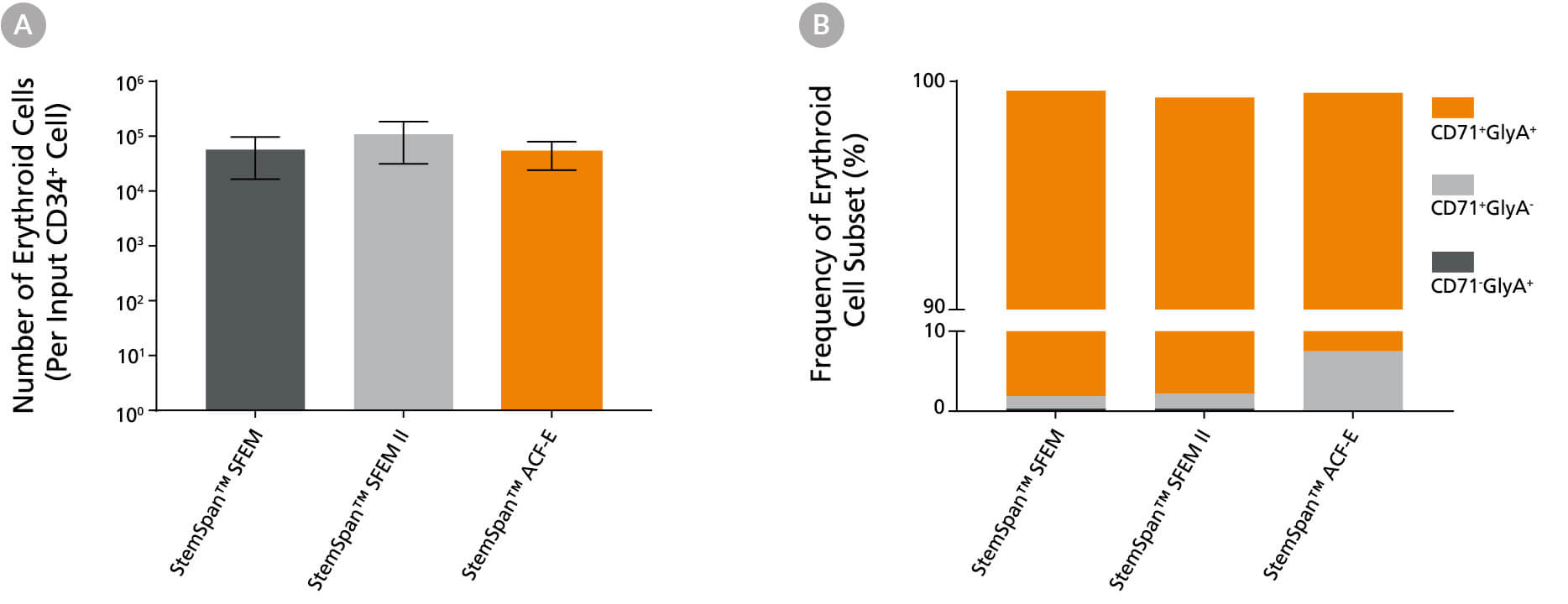
图6. 相比于测试的其他培养基,含红系细胞扩增添加物的 StemSpan™ SFEM II 无血清扩增培养基支持更好的红系细胞扩增
在含有StemSpan™红系细胞扩增添加物(产品号 #02692)的 StemSpan™ SFEM(黑色柱)、SFEM II(灰色柱)和 StemSpan™–ACF红系细胞扩增培养基(ACF–E,橙色柱-)中培养纯化的脐带血 CD34+ 细胞(n = 5),14 天后统计产生的红系细胞平均数量。图示为每接种一个 CD34+ 细胞生成的表达CD71和/或血型糖蛋白A(GlyA)的红系细胞数量。(B) 图中显示了上述培养体系中生成的不同红系细胞亚群比例,包括CD71+GlyA+幼红细胞、未成熟的CD71+GlyA-红系祖细胞与原幼红细胞,以及CD71-/lowGlyA+晚幼红细胞。三种培养基均支持每孔接种的脐带血 CD34+细胞生成数千个红系细胞。
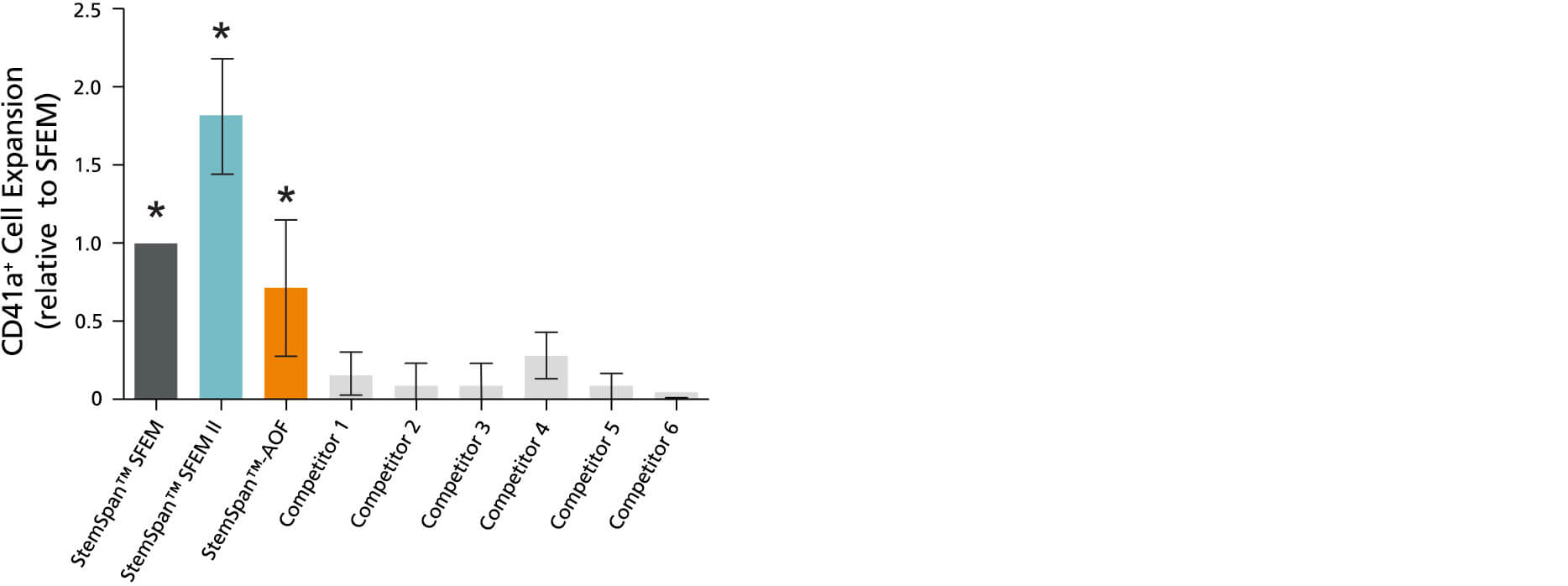
图7. 与测试的其他培养基相比,含巨核细胞扩增添加物的 StemSpan™ SFEM II 无血清扩增培养基支持更好的巨核细胞扩增
将纯化的脐带血CD34⁺细胞在StemSpan™ SFEM(深灰色柱)、SFEM II(金色柱)、AOF(橙色柱)以及其他6种商业化培养基(浅灰色柱;按随机顺序包括:StemLine II (Sigma)、HPGM (Lonza)、HP01 (Macopharma)、SCGM (Cellgenix)、StemPro34 (Life Technologies) 和X-Vivo-15 (Lonza))中培养14天后获得巨核细胞,以StemSpan™ SFEM培养基中的值为基准进行标准化。所有培养基均添加了StemSpan™巨核细胞扩增添加物(产品号 #02696)。竖线表示95%置信区间。StemSpan™系列培养基生成的细胞数量显著高于其他培养基(*P<0.01,配对t检验,n=6)。
注:所示的StemSpan™–AOF数据是使用原始的含酚红版本的 StemSpan™–ACF(产品号 #09855)生成的。然而,内部测试表明,新的不含酚红、cGMP生产的StemSpan™–AOF(产品号 #100-0130)性能相当。
表1. 人脐血CD34+细胞在含髓系扩增添加物或髓系扩增添加物 II 的 SFEM II 培养基中生成髓系细胞

结果显示在含有髓系扩增添加物(n=14)或髓系扩增添加物II(n=16)的SFEM II培养基中培养14天后,每接种一个人脐带血CD34+细胞产生的总有核细胞(TNCs)数量,以及髓系标志物CD13、CD14和CD15阳性细胞的百分比。*95%置信区间(CL);代表95%结果通常落入的范围。
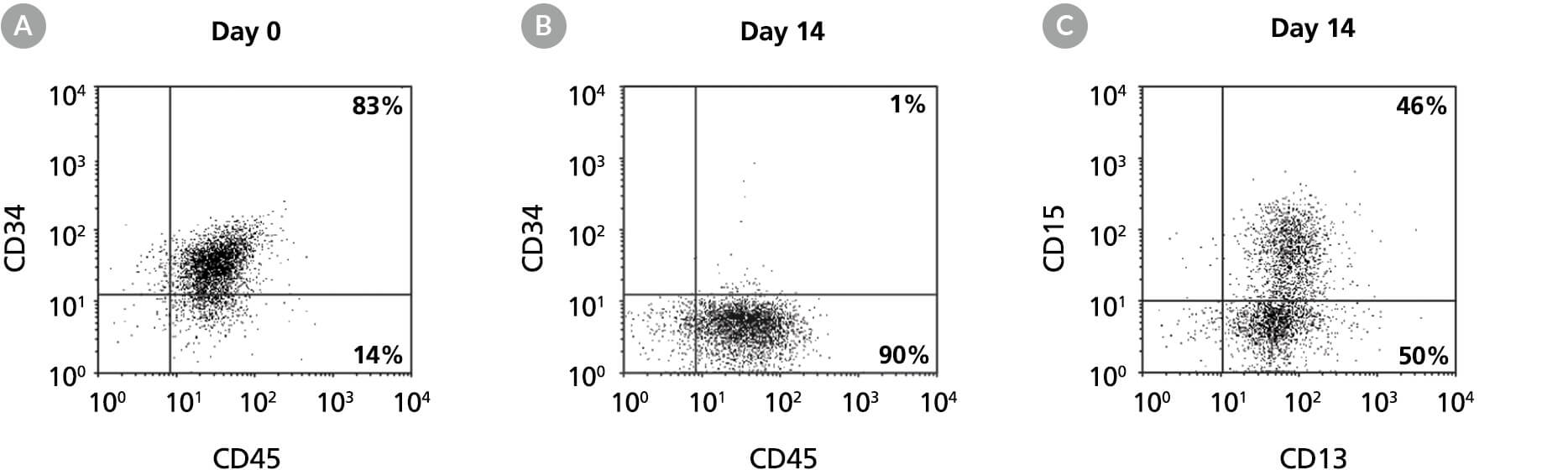
图8. 在含髓系扩增添加物的 StemSpan™ SFEM II 培养基中扩增和谱系特异性分化人骨髓来源细胞以生成 CD13+ 和 CD15+ 髓系细胞
流式细胞术点图显示人骨髓来源CD34+细胞在含髓系扩增添加物的 StemSpan™ SFEM II 培养基中培养14天:(A)培养前和(B)培养14天后 HSPC 标志物 CD34 与泛造血标志物CD45的表达,(C)培养14天后髓系标志物 CD13 和 CD15 的表达。结果显示,CD34+ 细胞比例从培养前的83%降至培养14天后的约1%。与此同时,髓系 CD13+CD15+ 细胞比例从第0天的<10%逐渐增加至第14天的46%。培养后CD14+细胞比例较低(通常<10%)。
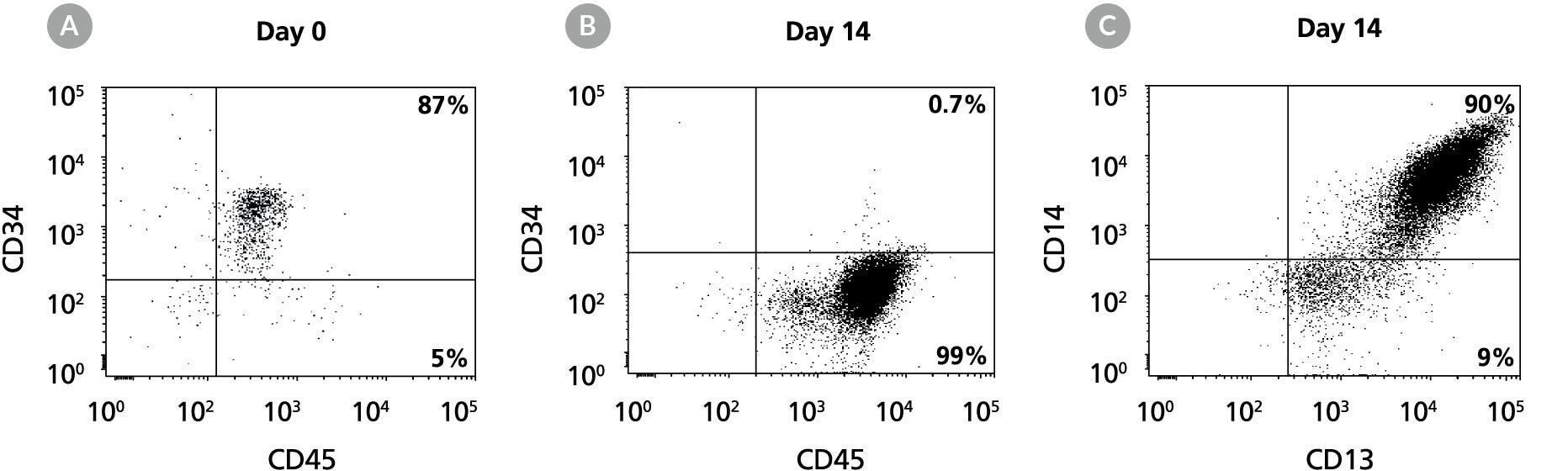
图9. 含髓系扩增添加物II的StemSpan™ SFEM II培养基中扩增和谱系特异性分化人脐带血CD34+细胞以生成CD14+单核细胞
流式细胞术点图显示人脐带血 CD34+ 细胞在含髓系扩增添加物II的StemSpan™ SFEM II培养基中培养14天,(A)培养前和(B)培养后CD34与CD45的表达,以及(C)扩增细胞中 CD13 和 CD14 的表达。结果显示,CD34+ 细胞比例从培养前的87%降至14天后的 <1%。CD14+单核细胞比例从第0天的<5%增至第14天的90%。
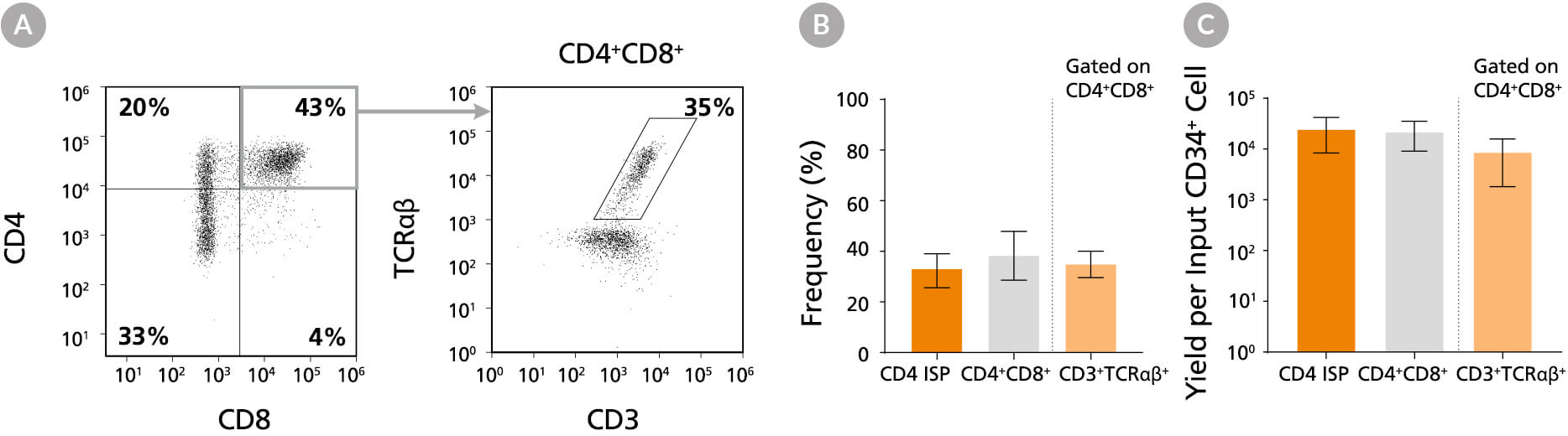
图10.培养42天后CD4未成熟单阳性细胞与CD4+CD8+双阳性细胞的比例及得率
使用 StemSpan™ T细胞生成试剂盒(产品号 #09940)培养脐带血来源的CD34+细胞(新鲜或冻存)42天,(A)通过流式细胞术检测CD4、CD8、CD3和TCRαβ表达,CD4未成熟单阳性细胞、CD4+CD8+双阳性细胞和表达 CD3+TCRαβ+的双阳性细胞(CD4+CD8+CD3+TCRαβ+)的平均(B)比例和(C)得率。结果显示,平均38%的活细胞为DP细胞(CD4++),其中35%共表达CD3和TCRαβ。每接种一个CD34+细胞产生的总DP细胞与CD3+TCRαβ+ DP细胞分别约为23,000个和9,000个。数据以平均值及95%置信区间表示(n = 31)。
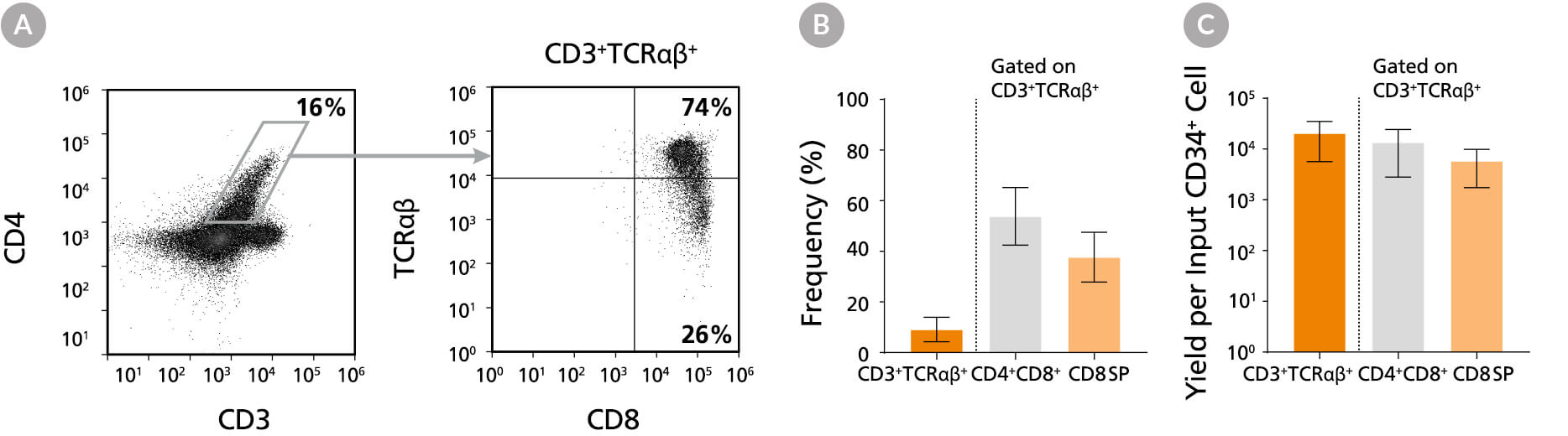
图11. 培养49天后CD8单阳性T细胞比例和得率
在含T细胞祖细胞成熟化添加物(产品号 #09930)、IL-15(产品号 #78031)和 ImmunoCult™ CD3/CD28/CD2 T细胞激活剂(产品号 #10970)的StemSpan™ SFEM II培养基中继续培养 CD4+ CD8+ 双阳性细胞7天,使其进一步成熟为CD8 单阳性T细胞。第49天时,(A)通过流式细胞术分析细胞 CD3、TCRαβ、CD4和CD8的表达情况,(B)表达CD3+TCRαβ+的细胞及其亚群的比例和得率。结果显示, CD3+TCRαβ+细胞中大约54%为DP(CD4+CD8+),38%为CD8 SP(CD4-CD8+)。每接种一个CD34+细胞平均产生约6,000个CD8 SP T细胞。CD3+TCRαβ+ CD4 SP(CD4+CD8-)T细胞的检出率极低(数据未显示)。数据以平均值及95%置信区间表示(n = 12)。
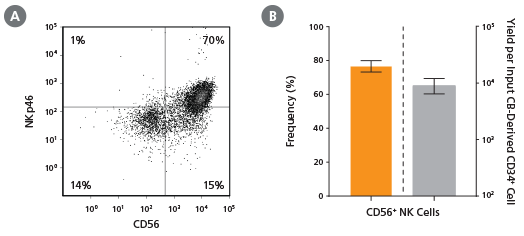
图12. 培养28天后CD56+ NK 细胞的比例与得率
使用 StemSpan™ NK 细胞生成试剂盒(产品号 #09960)培养脐带血来源的CD34+细胞(新鲜或冻存)28天,收获的细胞通过流式细胞术分析(A,B)CD56和(A)NKp46的表达情况。(B) CD56+ NK 细胞比例。通过光散射图和活细胞染色排除死细胞。(B)第28天时 CD56+ NK 活细胞的平均比例为77%,每接种1个脐带血 CD34+ 细胞可产生约9,000个 CD56+ NK 细胞。数据以平均值及95%置信区间表示(n=45,其中23例为新鲜分离样本,22例为冻存样本)。同时使用 StemSpan™ NK 细胞生成试剂盒培养骨髓来源的 CD34+ 细胞以分化为 NK 细胞,BM HSPC 的 NK 细胞得率通常低于 CB,平均每接种一个 CD34+ 细胞约产生75个NK细胞(n = 3,未显示数据)。
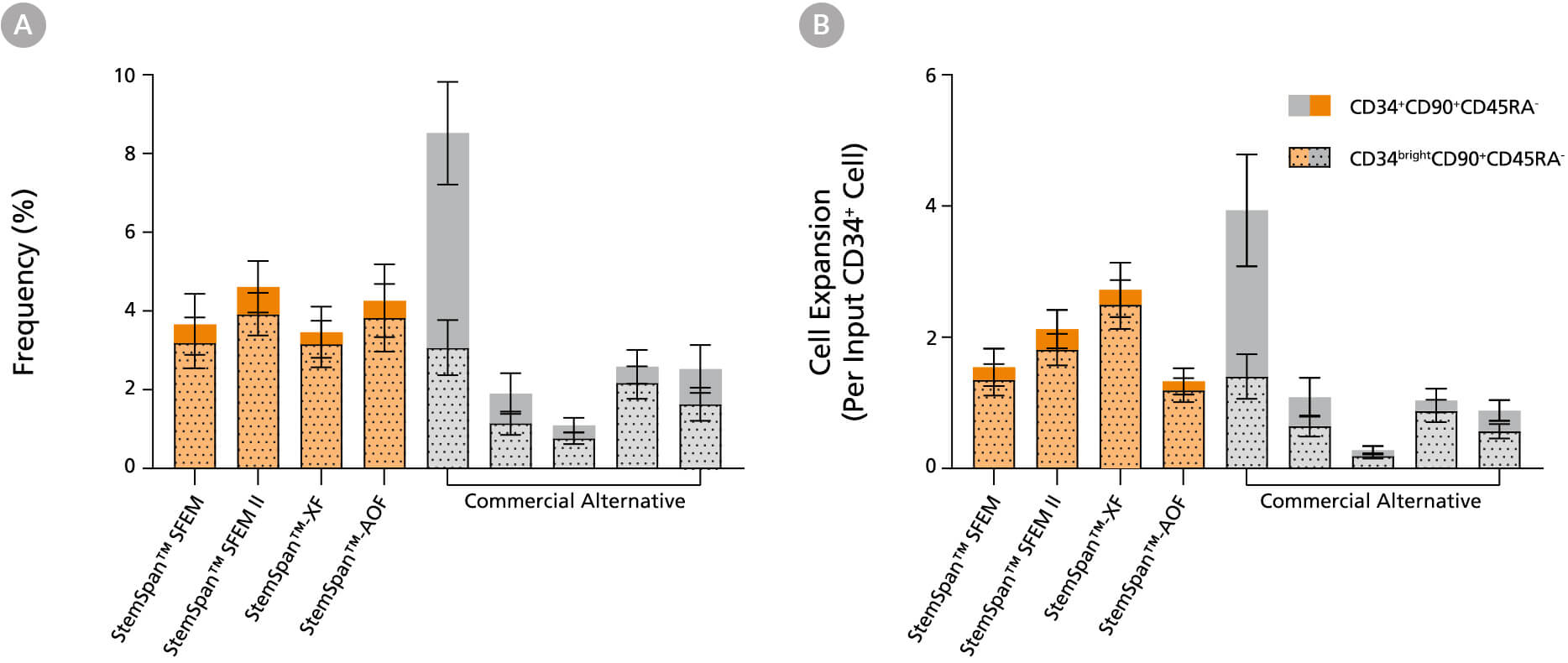
图13. 相比于测试的其他商业化培养基,StemSpan™ 培养基对人原始 CD34brightCD90+CD45RA- 细胞的扩增效果相当或更优
将纯化的脐带血来源 CD34+ 细胞在 StemSpan™ 培养基(SFEM、SFEM II、AOF和XF,橙色柱)和其他五种商业化培养基(灰色柱)中培养7天。所有培养基均添加了 StemSpan™ CD34+ 扩增添加物和 UM171*。如图1所示,通过流式细胞术分析培养物中 CD34+CD90+CD45RA-(实线)和 CD34brightCD90+CD45RA- (虚线叠加部分)活细胞的(A)比例及(B)扩增情况。与测试的其他商业化培养基相比,StemSpan™ 培养基对 CD34brightCD90+CD45RA- 细胞的扩增效果相当或显著更优(当 StemSpan™ SFEM II 和 XF 与其他五家商业化培养基相比时 P<0.05,采用单因素方差分析及 Dunnett 事后检验计算)。CD34brightCD90+CD45RA- 细胞群富含功能性干/祖细胞。数据以平均值 ±SEM 表示(n=8)。
当使用终浓度为 1μM 的 UM729(产品号 #72332)时,预计会得到类似的结果。有关更多信息,包括比较 UM171 和 UM729 的数据,请参阅 Fares et al., 2014。
注:所示的 StemSpan™–AOF 数据是使用原始的含酚红版本的 StemSpan™– ACF(产品号 #09855)生成的。然而,内部测试表明,新的不含酚红、cGMP 生产的 StemSpan™–AOF(产品号 #100-0130)性能相当。
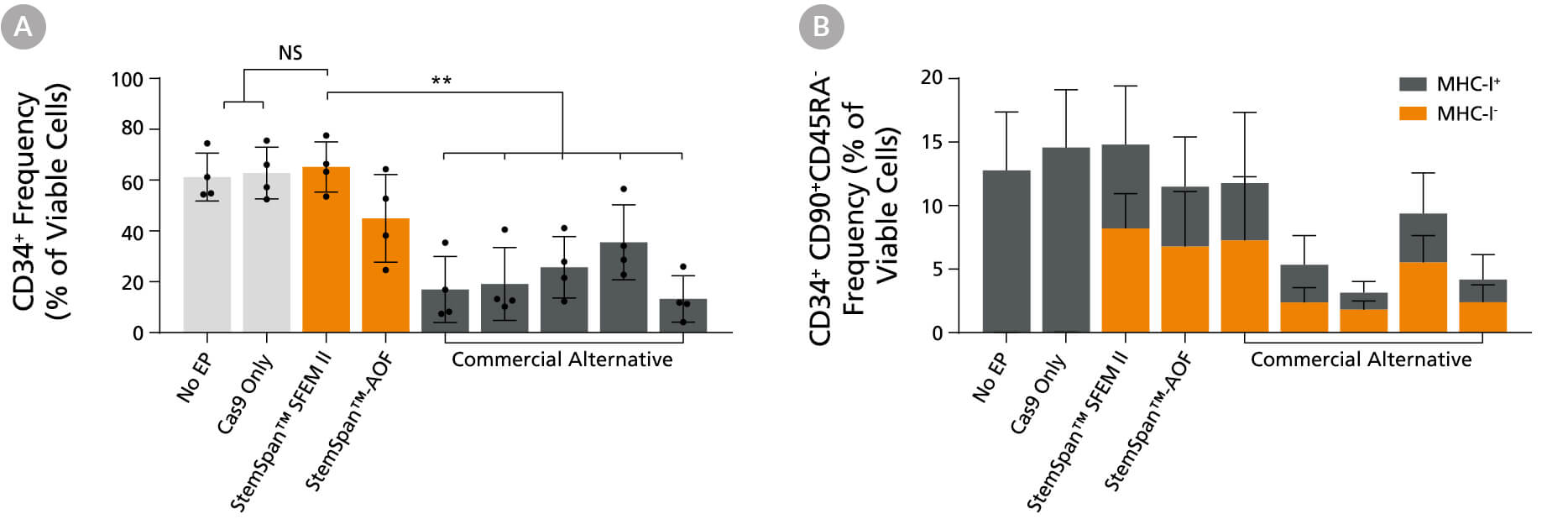
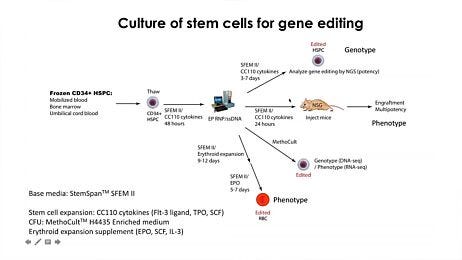
图14. 在基因组编辑应用中,与其他商业化培养基相比,StemSpan™ 培养基能更好地支持 CD34+ 及原始 CD34+CD90+CD45RA- HSPC的扩增
纯化的脐带血来源 CD34+ 细胞在特定 StemSpan™ 培养基(StemSpan™ SFEM II 或 StemSpan™-AOF,橙色柱)或其他五种商业化的无异源成分培养基(灰色柱)中培养2天。所有培养基均添加了 StemSpan™ CD34+ 扩增添加物和 UM171*。随后使用含有靶向β-2微球蛋白(B2M)的 crRNA:tracrRNA 的 Arcitect™ CRISPR-Cas9 RNP复合物对细胞进行电转,并在相同条件下继续培养4天。通过 MHC-I 染色和流式细胞术分析,所有培养基组均达到70-80%的相似敲除率。电转后4天,通过流式细胞术测定(A)CD34+ 细胞的比例(B)CD34+CD90+CD45RA 细胞的比例。
*数据以平均值±标准差(n=4名供体;**P<0.01)。当使用终浓度为 1μM 的 UM729(产品号 #72332)时,预计会得到类似的结果。有关更多信息,包括比较 UM171 和 UM729 的数据,请参阅Fares et al., 2014。
注:所示的 StemSpan™–AOF 数据是使用原始的含酚红版本的 StemSpan™– ACF(产品号 #09855)生成的。然而,内部测试表明,新的不含酚红、cGMP 生产的 StemSpan™–AOF(产品号 #100-0130)性能相当。

图15. CD34+ 慢性髓系白血病细胞在培养期间维持集落形成潜能
在 CD34+ 细胞分选后立即(第0天)或扩增7/14天(含或不含 UM171)后,使用 MethoCult™ H4435富集培养基对CML细胞进行集落形成实验(如图2所示)。在含 CD34+ 扩增添加物(Exp)的 StemSpan™ SFEM II 培养基中(含或不含UM171)培养14天后,(A)使用 STEMvision™ 对集落进行成像并通过数字图像进行手动计数。(B)集落形成单位(CFU)产量以每接种一个 CD34+ 细胞生成的总集落数表示。各柱状图上方的数字表示BCR-ABL阳性集落比例,该数据通过对6个不同样本中手工挑取的单个集落进行 qRT-PCR 测定(每个样本每个条件挑取8-12个集落)。添加了 CD34+ 扩增添加物(Exp)的 SFEM II 培养基支持培养体系中集落形成祖细胞的扩增。添加 UM171 可进一步提升集落形成祖细胞的产量(第7天约3.5倍扩增,第14天约8倍扩增)。单集落qRT-PCR分析显示:第0天样本产生的集落,以及经过7天和14天扩增的细胞产生的集落,主要为BCR-ABL+,但也存在少量正常BCR-ABL-祖细胞。数据以平均值 ± SEM 显示,n =3。P值采用双尾配对Student t检验计算(*P<0.05)。

图16. CD34+急性髓系白血病细胞在培养期间维持集落形成潜能
在 CD34+ 分选后立即(第0天)或扩增 7/14天(含或不含 UM171)后,使用 MethoCult™ H4435 富集培养基对AML细胞进行集落形成实验(如图3所示)。培养14天后,(A)使用 STEMvision™ 对集落进行成像并通过数字图像进行手动计数。(B)集落形成单位(CFU)产量以每输入一个CD34+细胞生成的总集落数表示。添加了CD34+
科学资源
Key Applications
Generation of Mature Blood Cells in Vitro
Leberbauer et al. (2005) Different steroids co-regulate long-term expansion versus terminal differentiation in primary human erythroid progenitors. Blood 105(1)
SFEM II
Huijskens et al. (2014) Technical advance: ascorbic acid induces development of double-positive T cells from human hematopoietic stem cells in the absence of stromal cells. J Leukoc Biol 96(6)
CC100
Kumkhaek et al. (2013) MASL1 induces erythroid differentiation in human erythropoietin-dependent CD34+ cells through the Raf/MEK/ERK pathway. Blood 121(16)
CC110
Gaikwad et al. (2007) In Vitro Expansion of Erythroid Progenitors from Polycythemia Vera Patients Leads to Decrease in JAK2V617F Allele. Exp Hema 35(4)
Ex Vivo Expansion of HSPCs for Rapid/Sustained Hematopoietic Recovery Post Transplantation
Delaney et al. (2010) Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nat Med 16(2)
Cutler et al. (2013) Prostaglandin-modulated umbilical cord blood hematopoietic stem cell transplantation. Blood 122(17)
Generating Target Cells for Reprogramming to Make Induced Pluripotent Stem Cells
Ohmine et al. (2011) Induced pluripotent stem cells from GMP-grade hematopoietic progenitor cells and mononuclear myeloid cells. Stem Cell Res and Therapy 2(6)
Gene Transfer into HSPCs
Lechman et al. (2012) Attenuation of miR-126 Activity Expands HSC In Vivo without Exhaustion. Cell Stem Cell 11(6)
SFEM II
Buechele C et al. (2015) MLL leukemia induction by genome editing of human CD34+ hematopoietic cells. Blood. Epub ahead of print

 EasySep™小鼠TIL(CD45)正选试剂盒
EasySep™小鼠TIL(CD45)正选试剂盒













 沪公网安备31010102008431号
沪公网安备31010102008431号