支持您的监管合规性需求
细胞疗法从实验室到临床的过渡并不总是一帆风顺的。特别是,辅助材料的选择和鉴定(AMs;也被称为原材料)对于研究人员和细胞治疗制造商来说是具有挑战性和令人困惑的。缺乏对AM的明确规定,以及供应商的合规声明,导致细胞治疗制造商和AM供应商的监管含糊不清。因此,为了确定最佳解决方案和通往临床的最顺畅途径,细胞疗法制造商和增材制造供应商必须密切合作,了解各自的监管和合规要求和能力。
以下是关于细胞治疗生产过程中辅助材料鉴定常见问题的解答,同时了解STEMCELL如何与您携手合作,更高效地完成这一过程。
辅助材料鉴定概述
什么是辅助材料或原材料?
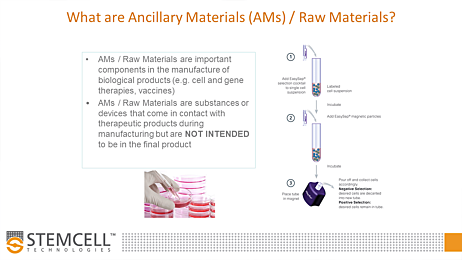
辅助材料(AMs)是指在细胞治疗产品生产过程中使用的组分、试剂和材料,但这些材料并不打算成为最终产品的组成部分。需要注意的是,“辅助材料”这一术语尚未得到全球监管机构的统一认可,不同地区对其命名也存在差异(例如,在欧洲其被称为“原材料”)。辅助材料可能包括细胞分离试剂、培养和冷冻保存培养基,以及一次性塑料制品和生物处理袋等耗材。
辅助材料的质量被广泛认为可能影响细胞治疗产品的疗效、安全性和一致性。因此,必须仔细评估辅助材料的化学和生物学特性及其对最终细胞治疗产品的影响。尤为重要的是,确立辅助材料的安全性和适用性对于细胞治疗产品的获批至关重要。。
细胞治疗生产中辅助材料(AMs)如何进行鉴定?
辅助材料(AM)鉴定是指建立特定辅助材料的来源、鉴别、纯度、生物安全性和总体适用性的过程。
为细胞治疗这种复杂的生产工艺选择并鉴定必要的辅助材料,对制造商而言既充满挑战又容易令人困惑。由于不存在适用于所有情况的“一刀切”鉴定方案,建议制造商采用基于风险的评估方法。1例如,虽然越来越多的辅助材料按照药品生产质量管理规范(GMP)生产,但最适合您细胞治疗应用的特定辅助材料可能并非GMP生产。这就引出一个关键问题:“它必须是GMP生产的吗?”
尽管目前仍缺乏针对辅助材料的明确法规,但已有若干资源和指南可用于制定辅助材料鉴定方案,包括:美国药典(USP)、国际标准化组织(ISO)和欧洲药典(Ph. Eur.)发布的标准。2-4如需更详细的辅助材料鉴定指南,请参阅 技术公报:辅助材料鉴定。
什么是cGMP ?
cGMP代表现行药品生产质量管理规范。GMP是质量管理体系(QMS)中的一系列流程、政策和控制措施,确保最终生产的产品对其预期用途安全有效。“现行”意味着尽管GMP法规是几十年前制定的,但遵守这些法规必须包括现行的行业标准、科学和技术。一般来说,cGMP和GMP可以互换使用。GMP的合规性要求贯穿于产品的整个生命周期,包括设计、制造、测试、标签等。
是否所有用于细胞治疗的AMs都需要在cGMP下生产?
各国法规要求可能存在差异,但在临床前研究和早期临床试验阶段生产细胞治疗产品时,并不一定严格要求使用按照相关cGMP生产的AMs。有关在细胞治疗制造中使用AMs的更多信息,请参阅 技术公报:辅助/原料鉴定.
即使我们的产品未按照GMP标准生产,STEMCELL仍有可能支持将其作为AMs使用——只需遵循美国药典(USP)第 <1043> 章或欧洲药典 Ph. 5.2.12 中概述的鉴定框架。2,4这些标准为评估辅助材料的安全性提供了指导原则。我们的AMs是在完善的质量管理体系(QMS)下生产的,该体系通常能提供足够的控制保障,满足临床前和早期临床试验的需求。我们的 细胞治疗服务 团队可随时与您协作,明确您的具体质量要求,并制定最契合您需求的解决方案。
细胞治疗制造需要什么“等级”的AM ?
与普遍认知相反,全球范围内并没有专门规定细胞治疗生产必须使用特定等级的AM。事实上,任何声称产品是“细胞治疗级”的说法,反映的只是市场驱动的命名方式,而非被认可的监管合规标准。不过,在健全的质量管理体系(QMS)下生产的AMs,确实能为细胞治疗制造商减轻鉴定负担。正因如此,优先选择在相关现行药品生产质量管理规范(cGMP)下生产的辅助材料,或是那些本身已被批准、许可的治疗性产品或医疗器械作为辅助材料,往往是更可取的做法。
需要特别指出的是,即使是作为AM使用的已获批治疗性产品,也必须针对其预期用途之外的应用进行验证。换言之,GMP或其他监管批准并不能确保某种特定的辅助材料就是生产您最终细胞治疗产品的最佳选择。
关于AM供应商与使用者各自责任认定的更多详情,可参阅Solomon et al. 2016中的表2。1
细胞疗法制造商如何简化AM资格认证?
最终,AM的鉴定责任主体是细胞治疗产品制造商。不过,通过与辅助材料供应商建立紧密合作关系,供应商的专业支持可以有效降低企业在AM鉴定过程中的合规难度,显著提升鉴定流程的效率。
供应商可通过提供质量证明文件、配合工厂审计、主动沟通AM变更信息,以及提供扩展检测或定制配方等方式协助制造商。更重要的是,制造商若能在早期阶段与AM供应商建立稳固的合作关系并保持清晰沟通,将能有效预判并解决AM使用过程中可能出现的各类问题。
有关制造商和AM供应商合作解决质量或监管问题的案例研究综述,请参见 Solomon et al. 2016 的表3。1
STEMCELL使用的辅助材料中,RUO、IUO和FFM的预期用途声明有什么区别?
仅供研究使用(RUO;非GMP生产)
此类产品主要用于非临床研究应用。通过适当的验证策略,RUO产品或许可以用于临床前研究。STEMCELL的RUO产品在符合ISO 5和ISO 7标准的洁净室中生产,并采用通过ISO 9001认证的质量管理体系,并实施相应的指控措施。STEMCELL的细胞治疗服务项目可提供更全面的产品测试和质量/法规文件等定制服务。
临床试验或研究使用**(IUO;符合GMP标准生产)
此类产品根据相关GMP标准开发和生产,用作细胞或基因治疗临床研究的辅助材料。这些产品旨在用于临床前和早期(I/II 期)临床试验。 STEMCELL致力于为这些产品提供主文件注册或同等支持,并在完成相关测试后将标签声明更新为“用于进一步生产或研究使用”。
用于进一步生产或研究使用(FFM;符合GMP标准生产)
这些产品根据相关GMP标准开发、生产、测试和上市,用作细胞或基因治疗工作流程中的辅助材料。这些产品旨在用于产品生命周期的各个阶段,包括后期临床试验和商业化。STEMCELL已完成严格的产品特性和安全性评估,包括完善的稳定性程序和经验证的质控措施,以确保产品符合预期用途。
**部分按照GMP标准生产的STEMCELL产品此前被标记为“RUO”。这些产品未来将先被标记为“用于临床试验或研究使用”,待完成所有必要的测试后,最终标签将更新为“用于进一步生产或研究使用”。
下表概述了这三种不同产品类型在设计、开发和生产细节方面的一些差异:
| 声明 | RUO | IUO | FFM |
|---|---|---|---|
| 仅供研究使用(非GMP) | 用于调查或研究用途(以前称为“研究用途”) (GMP) | 用于进一步生产或研究用途(GMP) | |
| 制造说明 | 符合 ISO9001 标准生产的产品 | 符合相关 cGMP 要求生产的产品 | 符合相关 cGMP 要求生产的产品 |
| 质量管理体系认证 | ISO9001
ISO13485 |
ISO9001
ISO13485 |
ISO9001
ISO13485 |
| 产品预期用途 | 非临床研究
临床前^ |
临床前
I/II 期 |
临床前
I - IV 期 商业化 |
| FDA 主文件 | 否 | 是的 | 是的 |
| 环境
监测 |
有限的 | 是的 | 是的 |
| 无菌工艺
模拟(APS) |
不 | 是的 | 是的 |
| 测试方法验证或确认 | 有限的 | 正在进行的 | 是 |
| 工艺验证(PV) | 不 | 有限的 | 是的 |
| 无菌测试 | 是 | 是的,药典 | 是的,药典 |
| 支原体检测 | 不 | 是的,药典 | 是的,药典 |
| 内毒素检测 | 产品特定 | 是的,药典 | 是的,药典 |
| 发货验证 | 不 | 有限的 | 是的 |
| 原料 | 可根据要求提供 CoO | 可根据要求提供 CoO | 可根据要求提供 CoO |
| 批次记录 | 质量保证审核 | 质量保证审核 | 质量保证审核 |
| 发布测试 | 是 - 请参阅 CoA | 是 - 请参阅 CoA | 是 - 请参阅 CoA |
GMP=良好生产规范;cGMP=现行良好生产规范;CoO=原产地证书;CoA=分析证书;QA=质量保证;^有限提供,需经资质确认
所列均为最低要求。具体产品信息请参阅相关产品说明书(PIS)或来电索取。您也可联系产品与科学支持部门techsupport@stemcell.com获取相关信息。
STEMCELL 如何支持您的监管需求?
秉持"科学家助力科学家"的理念,我们的目标是赋能科研人员及机构充分释放创新潜能。通过我们的细胞治疗计划服务,STEMCELL 将与您携手合作,在获得批准的IND申请、临床试验授权/申请(CTA)、生物制品许可申请(BLA)或同等监管备案的前提下,支持您按照如 USP 第 <1043> 章或 Ph. Eur 通则 (5.2.12)2,4 的规定使用我们的产品作为AM。我们已成功支持全球100多项临床试验,其中包括一项以STEMCELL产品为辅助材料的商业化细胞疗法。
为什么要和我们合作?
- 我们已与全球客户合作,助力其满足所在国家或地区的特定监管要求。
- 通过严格的供应商资质审核与管理流程,我们确保产品与服务质量始终如一,供应稳定可靠。
- 部分核心产品由我们自有工厂按照相关cGMP标准生产测试,并具备支持USP <1043> 或 Ph. Eur. 5.2.12 标准下AM鉴定的能力。
- 依托全球合格分销网络,我们能够为世界各地的客户提供高效的产品配送服务。
为设计并达成最契合您需求的解决方案(如提升合规性的定制化生产服务),我们将为您指派专属项目经理。该经理将全程指导您完成以下流程:全面了解您的需求,共同确认交付成果。从项目启动到最终完成,您的项目经理将保持密切沟通,让您全程掌握项目进展。我们可扩展的工艺流程与合规能力,能为您从临床前研究到商业化的整个发展历程提供支持。

深耕科研试剂领域三十载,现运营体系已通过ISO 13485:2016与ISO 9001:2015质量管理体系认证,彰显我们对品质的不懈追求。虽然公司产品多属科研专用(RUO),但根据具体用途,部分产品会按照更高等级的质量标准生产。需要特别说明的是,RUO标识并不影响产品符合GMP要求,也不会成为临床应用的障碍。对于所有GMP级别的辅助材料(AM)产品,我们均可提供具有病毒安全性的证明文件。
获取相关文件与监管资料
需要查阅文件?您可通过下方链接访问我们的部分证书及文档。如果你找不到你需要的东西,若您在查找过程中遇到任何困难,请 联系我们。
ISO 13485:2016,ISO 9001:2015 和 ISO 14001:2015 认证
STEMCELL 运营的质量管理体系已通过 ISO 13485:2016 和 ISO 9001:2015 的认证,适用于以下范围:
体外诊断(IVD)产品、RUO产品、试剂和实验室设备的设计、制造、分销和销售。这些产品还配套提供以下服务:合同检测、能力验证以及培训服务。
此外,STEMCELL 的环境管理体系已通过 ISO 14001:2015 认证,该体系旨在量化并减少我们的环境足迹。
我们的证书可在下方下载:
ISO 13485:2016
ISO 13485:2016医疗器械是医疗器械领域全面质量管理体系的国际标准,证明组织具备持续设计和生产符合客户及适用法规要求的医疗器械及相关服务的能力。
ISO 9001:2015
ISO 9001:2015是国际通用的质量管理体系标准,规定了建立、实施和维护质量管理体系的基本要求,证明组织具备持续提供符合客户和法规要求的产品和服务的能力。该标准是全球最广泛应用的质量管理体系方法。
ISO 14001:2015
ISO 14001:2015为企业和组织建立有效的环境管理体系提供了框架指南。该认证表明STEMCELL致力于衡量和改善其环境影响。&
机构注册许可
STEMCELL 已获得 加拿大卫生部 和 美国食品及药物管理局 的机构注册许可。
授权信(LOA)请求
STEMCELL致力于支持您的临床旅程,并将为我们的每个GMP产品提交主文件(MF)。若您需要在FDA申请中引用STEMCELL的主文件,请填写我们的在线授权信(LOA) 申请表格。
如果您位于美国以外,STEMCELL可以与您合作,直接向您的监管机构提供监管支持文件,以支持您的申报工作。请 在这里联系我们 或者通过您当地的代表。
检验报告书
您可通过 本表格 在线查询获取检验报告书。
术语表
通用质量、法规和遵从性术语和缩略语的定义
- 辅助材料(AMs):这些是细胞治疗产品生产过程中使用的成分、试剂和材料,但不打算成为最终产品的一部分。AMs也可以指北美以外的原材料。
- 生物制剂许可协议(BLA):向美国食品和药物管理局(FDA)提交的申请,要求允许将一种生物制品推向市场。BLA必须提供足够的材料和数据来评估产品的安全性和有效性。
- 纠正和预防措施(CAPA)程序:一个确定的过程来调查问题或不符合,分析根本原因,并采取适当和有效的纠正措施以防止其再次发生。
- 现行良好生产规范(cGMP):cGMP是一些监管机构建议或要求制造商确保其产品始终符合其预期用途要求的一套最低限度的做法。“现行”意味着尽管GMP法规是几十年前制定的,但遵守这些法规必须包括现行的行业标准、科学和技术。一般来说,cGMP和GMP可以互换使用。
- 分析证明书(CoA):质量保证部门出具的确认产品符合其规格的文件。CoA上的信息将根据具体产品而有所不同。
- 产地来源证(CoO):由供应商提供的文件,显示制造产品所用原材料的来源和加工信息。这些信息可用于评估产品的安全性或适用性。
- 临床试验授权/申请(CTA):向监管机构申请在特定国家进行临床试验。
- 合规:符合规定的规格、合同条款、规定或标准的状态。
- 良好生产规范(GMP):质量管理体系中的一系列流程、政策和控制措施,确保最终生产的产品对其预期用途安全有效。参见上面的cGMP。
- 国际标准化组织(ISO):一个独立的非政府国际组织,它联合专家分享知识并制定自愿的、基于共识的、与市场相关的国际标准和准则。
- 新药(IND)申请:向美国食品和药物管理局(FDA)申请允许在临床试验中使用新药的请求。
- 体外诊断(IVD)产品一般来说,IVD产品是那些用于诊断疾病或其他病症的试剂、仪器和系统,包括确定健康状况,以治愈、减轻、治疗或预防疾病或其后遗症。这些产品用于采集、制备和检查人体标本。IVD法规在世界各地各不相同,供应商必须根据国家特定要求注册产品(例如欧盟的CE标志)。有关ivd注册STEMCELL产品的完整列表,请参阅我们的监管产品和仪器页面。
- 授权书(LOA):持有人或指定代理人或代表的书面声明,允许FDA参考MF中的信息以支持其他人的提交。
- 主文件(MF):在药品的制造、加工或包装过程中提供有关特定工艺或成分信息的参考资料。
- 仅供研究使用(RUO):表明该产品仅用于研究用途,除非另有说明,否则不用于人类或动物的诊断或治疗用途。
- 仅供临床试验使用(IUO):表示该产品根据相关GMP标准开发和生产,用作细胞或基因治疗临床研究的辅助材料。其设计用途为临床前和早期(I/II期)临床试验。
- 仅供后续生产使用(FFM):表示该产品根据相关GMP标准开发、生产、测试和上市,用作细胞或基因治疗工作流程中的辅助材料。其设计用于产品生命周期的所有阶段,包括后期临床试验和商业化。
- 质量管理体系(QMS):实现质量方针和目标的过程、程序和职责的正式体系。
额外的资源
参考文献
- Solomon J et al. (2016) Current perspectives on the use of ancillary materials for the manufacture of cellular therapies. Cytotherapy 18(1): 1–12.
- General Chapter <1043> Ancillary materials for cell, gene, and tissue engineered products. (2017) In: The United States Pharmacopeia.
- ISO/TS 20399-1,-2,-3 (2018) Biotechnology - Ancillary materials present during the production of therapeutic products. International Organization for Standardization.
- Chapter 5.2.12. Raw materials for the production of cell-based and gene therapy medicinal products. In: European Pharmacopeia.

 EasySep™小鼠TIL(CD45)正选试剂盒
EasySep™小鼠TIL(CD45)正选试剂盒









 沪公网安备31010102008431号
沪公网安备31010102008431号