使用 EasySep™ Release 小鼠正选试剂盒分离 CD45.1 或 CD45.2 阳性细胞
- 文档编号 #27226
- 版本 1.0.0
- 2025年1月
目录
简介
CD45 是一种存在于所有有核造血细胞表面的I型跨膜分子,因其在不同小鼠品系的免疫细胞(如白细胞)中的高表达性,是分离小鼠免疫细胞的理想标志物。1,2 CD45 因其 mRNA 的选择性剪接而存在多种异构体。3 在小鼠中,CD45.1 和 CD45.2 是同一功能蛋白的常见异构体,通常用于区分不同遗传背景、品系和细胞群。4 CD45.1 和 CD45.2 的等位基因仅在其胞外域有5个氨基酸差异,但胞质域完全相同。4 这种胞外段的细微差异变化修饰表面表位,可通过单克隆抗体特异性识别各自异构体的特定表位。4 CD45 表达水平高,其修饰通常不会影响其他细胞功能。
小鼠CD45.1和CD45.2细胞群是干细胞和免疫学研究的重要工具,具有广泛的应用。例如,通过分析 CD45.1 和 CD45.2 阳性细胞,科学家可以:(1)检测受体小鼠模型的嵌合现象;(2)设计过继转移实验以治测试治疗效果或模拟疾病来分析免疫功能和行为;(3)开展竞争性研究(健康细胞与突变细胞竞争),评估细胞相互作用及其对免疫和非免疫细胞的影响等。1
本技术公告首次推出两种实验方案,相比现有方法具有显著优势——可在细胞分选后解离结合的磁珠。EasySep™ Release 技术能够高效分离出高纯度、不含磁珠的细胞,可无缝衔接各类下游应用(如单细胞测序、DNA/RNA 分析等)。
为何选择 EasySep™ Release 技术分离 CD45.1 和 CD45.2 阳性细胞?
- 从目的细胞表面去除磁珠*
- 在44-60分钟内获得纯度高达95%的目的细胞
- 只需通过一次倾倒即可轻松分离出目的细胞
- 通过温和的 EasySep™ 技术获取功能性细胞
- 适用于细胞起始比例不同的样本
*重要提示:使用 EasySep™ Release 试剂盒分离细胞后,抗体复合物仍结合于细胞表面,可能与 Brilliant Violet™ 抗体偶联物、聚乙二醇修饰蛋白或其他化学相关配体发生相互作用。
EasySep™ Release 技术原理
磁珠分选(免疫磁珠分选或磁珠分选)通过靶向细胞表面抗原的抗体或配体对细胞进行选择或去除。被标记的细胞与磁性颗粒(磁珠)交联,在施加电磁场后磁珠被吸附。小鼠 CD45.1 和 CD45.2 阳性细胞的分选通常采用免疫磁珠正选。分选完成后,磁珠通常仍结合于目的细胞表面。但本技术公告中的方案允许您通过EasySep™ Release 技术在正选后解离结合的磁珠。了解如何分别使用 EasySep™ Release 小鼠生物素正选试剂盒(产品号 #17655)和 EasySep™ Release 小鼠PE正选试剂盒(产品号 #17656)分离 CD45.1 和 CD45.2 阳性细胞,并获得无磁珠标记的高纯度细胞(图 1 和 2)。此外,还可了解如何从细胞起始比例不同的小鼠样本中分离细胞而不影响纯度(图 1B 和 2B)。

样本制备
小鼠脾脏样本处理
有关如何从小鼠脾脏样本制备单细胞悬液的详细信息,请按照以下步骤操作。该方案也可在 EasySep™ Release小鼠生物素正选试剂盒(产品号 #17655)的产品说明书 (PIS) 中找到。
- 用 EasySep™ 缓冲液(产品号 #20144)解离脾脏
- 使用 70 μm 尼龙滤网(如产品号 #27216)去除聚集物和碎片
- 300 x g 离心10分钟
- 按表1(步骤1)重悬样本,冰上保存备用
注意:用于细胞分选应用时不建议使用氯化铵裂红。
也可参考小鼠脾脏单细胞悬液制备方案及视频。
从其他组织解离小鼠CD45.1或CD45.2阳性细胞?
可能需要优化实验步骤,请通过联系我们。info.cn@stemcell.com获取支持。
实验步骤
表1详细说明了使用 EasySep™ Release 小鼠生物素正选试剂盒(产品号 #17655)和 EasySep™ Release 小鼠 PE 正选试剂盒(产品号 #17656)分别分离 CD45.1(中间列)和 CD45.2(右侧列)阳性细胞的步骤。
重要提示:两种方案均需使用紫色 EasySep™ 磁级(产品号 #18000),并针对小鼠脾细胞(CD45.1)和小鼠骨髓细胞(CD45.2)优化。
| 操作步骤 | 使用 EasySep™ Release 小鼠生物素正选试剂盒(产品号 #17655)分离 CD45.1 阳性细胞 | 使用 EasySep™ Release 小鼠 PE 正选试剂盒(产品号 #17656)分离 CD45.2 阳性细胞 |
|---|---|---|
1. 按推荐体积调整细胞浓度,用 EasySep™ 缓冲液(产品号 #20144)重悬细胞。 |
1 x 108 细胞/mL 推荐体积:0.25 - 0.5 mL |
|
将样本加入指定规格的试管中。 |
5 mL 聚苯乙烯圆底试管(如产品号 #38007) |
|
2. 添加 EasySep™ 小鼠 FcR 阻断剂(先于分选抗体加入)。 |
每 mL 样本加 40 μL* |
|
3. 加入对应偶联抗体。 注意:可能需要滴定抗体以获得最佳纯度和回收率。请联系 info.cn@stemcell.com 获取建议。 |
每 mL 样本加 0.25 µg 生物素偶联抗小鼠 CD45.1 抗体(克隆 A20,产品号 #60117BT) |
每 mL 样本加 1.0 µg PE 偶联抗小鼠 CD45.2 抗体(克隆 104,产品号 #100-1596) |
混匀并孵育。 |
室温孵育5分钟 |
|
4. 加入推荐缓冲液**至指定体积。 |
补液至2.5 mL |
|
离心样本。 |
300 x g 离心10分钟 |
|
5. 加入对应的 EasySep™ Release 正选试剂。 注意:(1)请勿涡旋抗体混合物;(2)可能需要滴定抗体混合物以获得最佳效果,请联系技术支持。 |
每 mL 样本加 50 µL EasySep™ Release 生物素正选抗体混合物 |
每 mL 样本加 50 µL EasySep™ Release PE 正选抗体混合物 |
混匀并孵育。 |
室温孵育3分钟 |
|
6. 加入 EasySep™ Releasable RapidSpheres™。 注意:使用前涡旋 RapidSpheres™ 30 秒以确保磁珠均匀分散。 |
每 mL 样本加 100 µL |
|
混匀并孵育。 |
室温孵育3分钟 |
|
7. 进行免疫磁珠分选: |
补液至2.5 mL |
|
将无盖试管放入紫色 EasySep™ 磁极(产品号 #18000)。 |
室温静置 5 分钟  |
|
拿起磁极,快速倒置以倾倒上清液。取出含目的细胞的离心管。 |
弃去上清液 |
|
8. 按指示重复步骤。 |
重复步骤 7: |
|
9. 加入 1X EasySep™ Release 缓冲液至指定体积,轻柔吹打混匀 2-3 次。 注意:1X EasySep™ Release 缓冲液需现用现配(用推荐缓冲液**按 1:40 稀释浓缩液)。 |
补液至 2.5 mL |
|
孵育。 |
室温 3 分钟 |
|
10. 将不加盖的试管放入磁极并孵育。 |
室温静置 5 分钟 |
|
11. 拿起磁极,快速倒置并将富集的细胞悬液倒入新试管。 |
保留上清液(新试管中):  |
|

支持数据:获取无磁珠标记的高纯度细胞
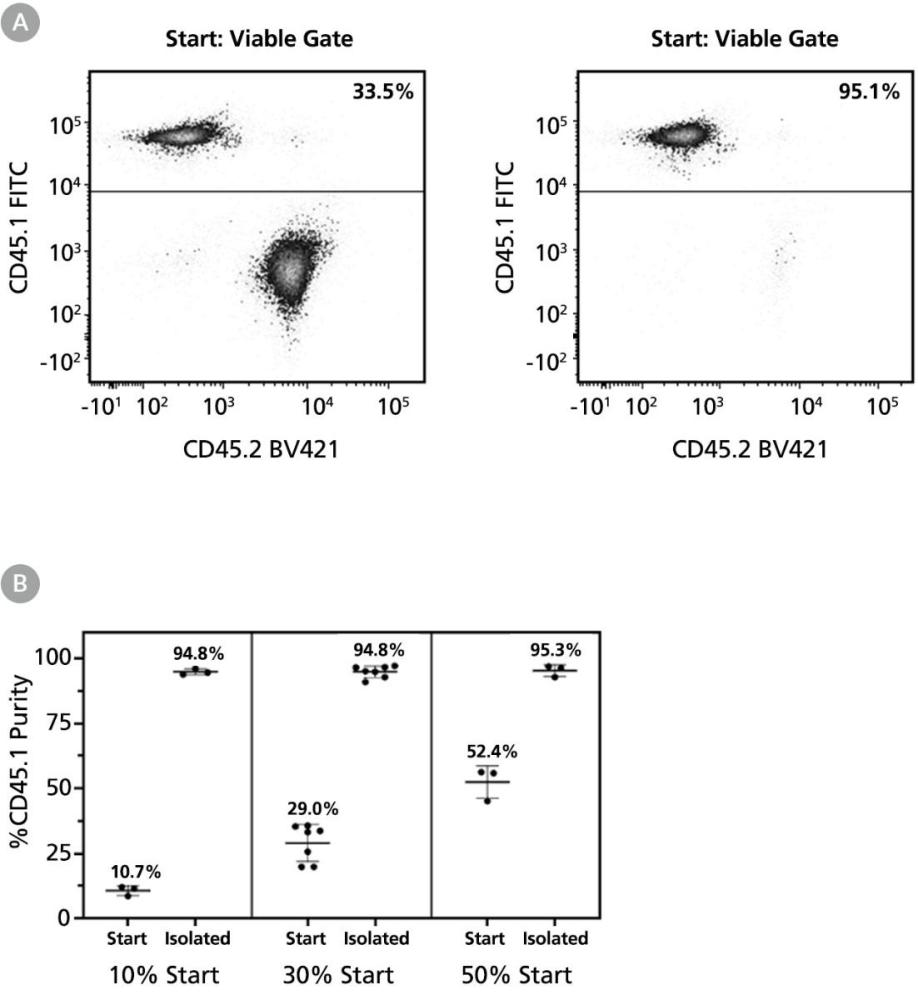
图 1. 使用 EasySep™ Release 小鼠生物素正选试剂盒可获得高纯度的CD45.1阳性细胞
实验步骤参考本技术公告“实验步骤”部分(表1),使用紫色 EasySep™ 磁极(产品号 #18000)、EasySep™ Release 小鼠生物素正选试剂盒(产品号 #17655)和生物素偶联抗小鼠 CD45.1 抗体(克隆 A20,产品号 #60117BT)。
(A) 可获得高纯度的CD45.1阳性细胞。起始样本为30% CD45.1阳性的小鼠脾细胞(与CD45.2阳性脾细胞混合),分选后的CD45.1阳性细胞含量为94.8% ± 2.3%(平均值 ± 标准差)。在上述示例中,起始样本和最终分选后的CD45.1细胞纯度分别为33.5%和95.1%。
(B) 在不同的细胞起始比例下仍可分离出高纯度的目的细胞。
将CD45.1阳性脾细胞与CD45.2阳性脾细胞按约 10%、30%、50%混合,分选后的CD45.1阳性细胞的纯度分别为94.8%±1.1%、94.8%±2.3%、95.3%±2.2%。
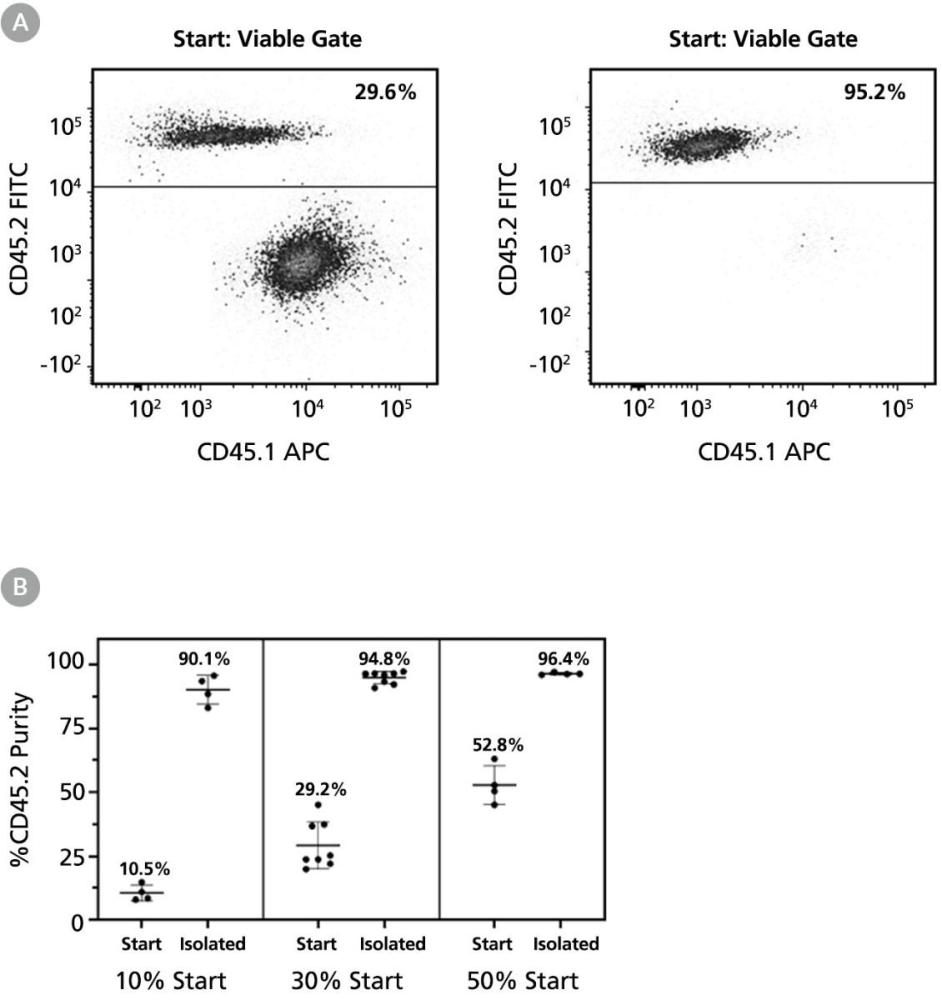
图 2. 使用 EasySep™ Release 小鼠 PE 正选试剂盒分离CD45.2阳性细胞纯度高
实验步骤参考本技术公告“实验步骤”部分(表1),使用紫色 EasySep™ 磁极(产品号 #18000)、EasySep™ Release 小鼠 PE 正选试剂盒(产品号 #17656)和 PE 偶联抗小鼠 CD45.2 抗体(克隆104,产品号 #100-1596)。
(A) 典型分离纯度达 94.8%+2.4%(起始纯度 29.6%,分离后 95.2%)。
(B) 不同起始频率下纯度保持稳定。
将 CD45.2 阳性骨髓细胞与 CD45.1 阳性骨髓细胞按约 10%、30%、50% 混合,分选后的CD45.1阳性细胞的纯度分别为 90.1% ± 1.9%、94.8% ± 2.4%、96.4% ± 0.5%。
产品信息
参考文献
- Mercier FE et al. (2016) Single targeted exon mutation creates a true congenic mouse for competitive hematopoietic stem cell transplantation: the C57BL/6-CD45.1(STEM) mouse. Stem Cell Rep 6(6): 985–92.
- Hermiston ML et al. (2009) CD45, CD148, and Lyp/Pep: critical phosphatases regulating Src family kinase signaling networks in immune cells. Immunol Rev. 228(1): 288–311.
- Penninger JM et al. (2001) CD45: new jobs for an old acquaintance. Nat Immunol. 2(5): 389–96.
- Jang Y et al. (2018) Cutting Edge: Check Your Mice-A Point Mutation in the Ncr1 Locus Identified in CD45.1 Congenic Mice with Consequences in Mouse Susceptibility to Infection. J Immunol. 200(6):1982–7.
- Heib T et al. (2021) Isolation of murine bone marrow by centrifugation or flushing for the analysis of hematopoietic cells - a comparative study. 32(5): 601–7.


 EasySep™小鼠TIL(CD45)正选试剂盒
EasySep™小鼠TIL(CD45)正选试剂盒





